Las técnicas de injerto óseo evolucionan constantemente en la odontología con el objetivo de alcanzar la regeneración ósea y de tejido con menor morbilidad y costo y tiempo de tratamiento reducidos.
La primera generación de agregados plaquetarios incluía el plasma rico en plaquetas (PRP) y el plasma rico en factores de crecimiento (PRGF). Ya el PRF es un plasma rico en plaquetas que sufre coagulación natural. El uso y obtención del PRF es más sencillo, requiere menos tiempo, no requiere el uso de anticoagulantes, así como de aditivos artificiales que influencien en la cascada de coagulación como la trombina bovina y el cloruro de calcio.El uso de la fibrina rica en plaquetas y leucocitos (L-PRF) se convirtió en una alternativa de tratamiento en casos en donde hay la necesidad de regeneración, tanto de tejidos blandos como de tejidos duros. Esta segunda generación de concentrados plaquetarios que son extraídos de la sangre y obtenidos después del procesamiento por medio de centrifugación fue introducida por Choukroun y colaboradores en 2001.
El protocolo de obtención del L-PRF consta de la cosecha de sangre del propio paciente por venopunción, en tubos de 9-10mL revestidos por vidrio/plástico que deben ser centrifugados inmediatamente en alta velocidad a 400g RCF: 2700 rpm durante 12 minutos o 3000 rpm durante 10 minutos. Después de la centrifugación los constituyentes de la sangre se dividen en tres camadas.
En el fondo del tubo quedan acumuladas las células rojas de la sangre, en la parte superior el plasma pobre en plaquetas y la camada intermediaria está compuesta por la mayor concentración de plaquetas y leucocitos (coágulo de fibrina que llamamos de L-PRF), conforme demostrado en la figura 1.
Figura 1 – esquema del tubo de vidrio después de la centrifugación. Se puede observar que en el fondo del tubo estarán las células rojas, arriba, con más consistencia el coágulo de fibrina, que será quitado con la pinza y utilizado para confección de las membranas y el plasma pobre en plaquetas, que será desechado.
En pocos minutos la activación de la mayoría de las plaquetas de la muestra de sangre se da por contacto con las paredes de vidrio del tubo de cosecha lo que desencadena la cascada de coagulación.
El coágulo de L-PRF es rico en fibrina, plaquetas, leucocitos, monocitos y factores de crecimiento. Estudios sugieren un efecto positivo en la proliferación, migración, adhesión, diferenciación celular y en el proceso inflamatorio, lo que justifica su amplio uso en la odontología.
¿Cómo utilizar clínicamente?
Para el uso clínico del L-PRF el coágulo es sacado del tubo con una pinza y la porción de células rojas adheridas al coágulo es entonces retirada con una espátula, tijera o lámina de bisturí.
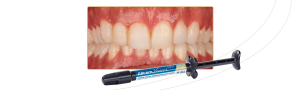
El coágulo de fibrina, por compresión, puede ser transformado en plugs, siendo indicados, por ejemplo, para el vedado de alvéolos post extracción (figura 2), o membranas con 1mm de espesor, además de servir como andamiaje para la aglutinación de partículas de sustitutos óseos, como Nanosynt, por ejemplo.
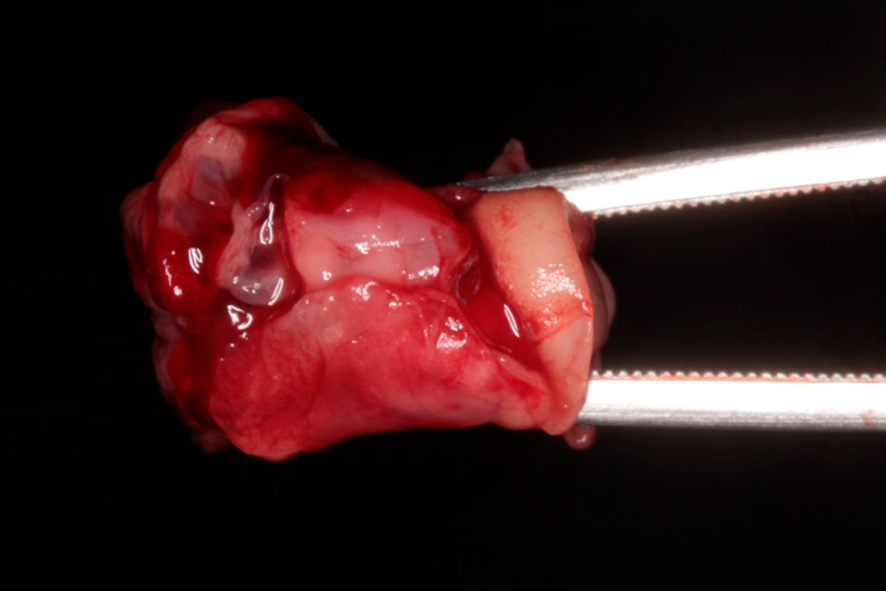
Figura 2 – imagen de un plug de L-PRF, preparado después de la compresión dentro de un cilindro. Para la obtención de éste, es necesario la centrifugación de la sangre en el tubo de vidrio, por 12 minutos. Después de la centrifugación, debe ser retirada la parte intermediaria – mayor concentración de plaquetas y leucocitos con una pinza y llevada para adentro del cilindro disponible en la caja de L-PRF. Con el auxilio de una pinza, llevar el plug para el local deseado
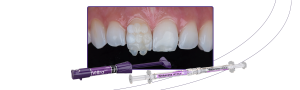
Para la formación de la membrana, el coágulo de fibrina es ubicado sobre una superficie perforada en una caja metálica (PRF box) (figura 3), siendo comprimido por acción de la gravedad con la ayuda de la placa metálica de la caja por un período de 5 minutos.
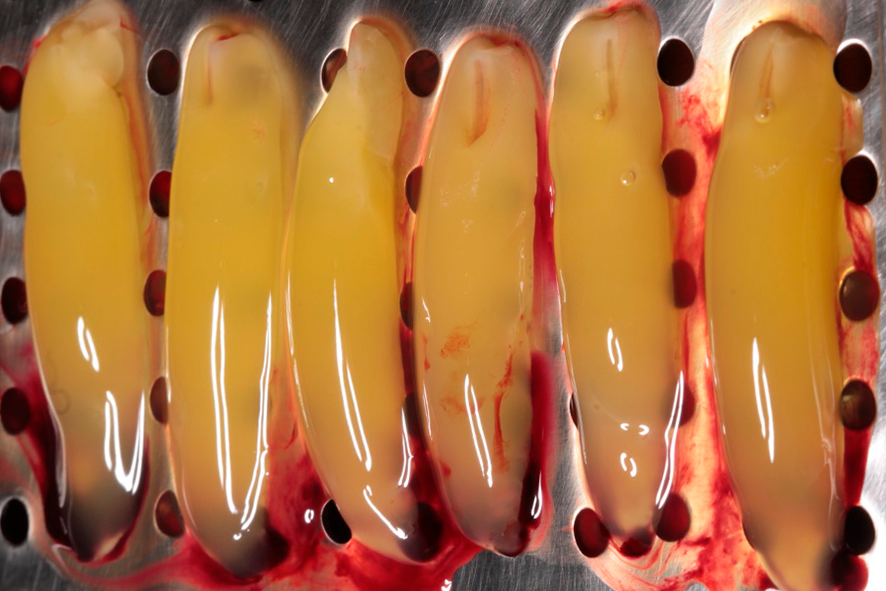
Figura 3 – La figura 3 muestra la apariencia del coágulo de fibrina (parte intermediaria) así que retirado del tubo de vidrio. Éstos deben ser comprimidos con la tapa de la caja, para que entonces las membranas se formen y estén listas para el uso. La exudación que se deriva de ese proceso puede ser utilizado como fuente de irrigación de biomateriales.
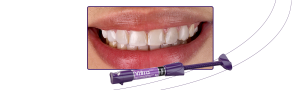
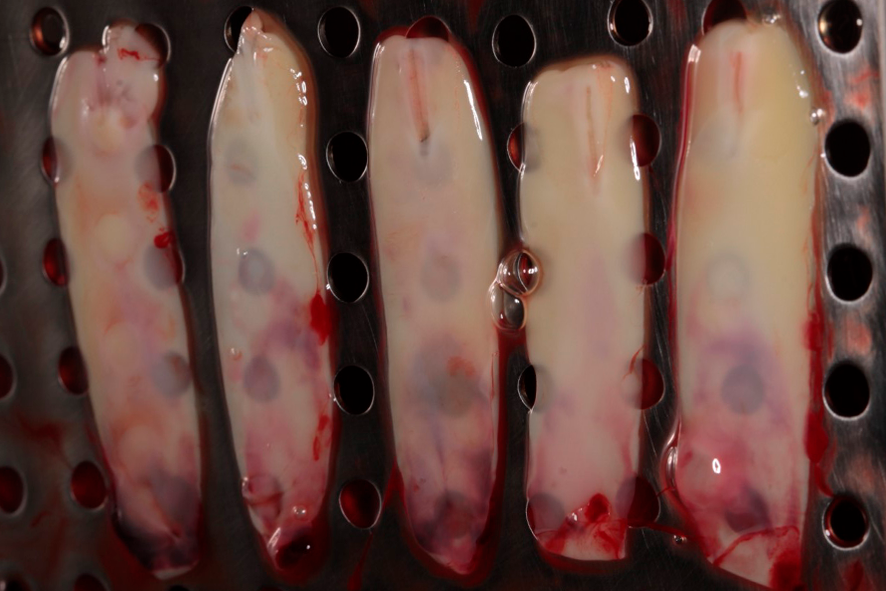
La exudación liberada por el coágulo, debido a su compresión, quedará almacenado en el compartimiento inferior de la caja. Esta exudación es rica en proteínas (fibronectina y vitronectina) y podrá ser utilizada para hidratar injertos y biomateriales, así como para lavar heridas quirúrgicas. Las figuras 4 y 5 muestran las membranas después de la compresión, ya listas para el uso, pudiendo ser utilizadas para recubrir el palato que sirvió como área donadora de injerto gingival, así como en el área receptora, para auxiliar en la formación de tejido queratinizado;
 |
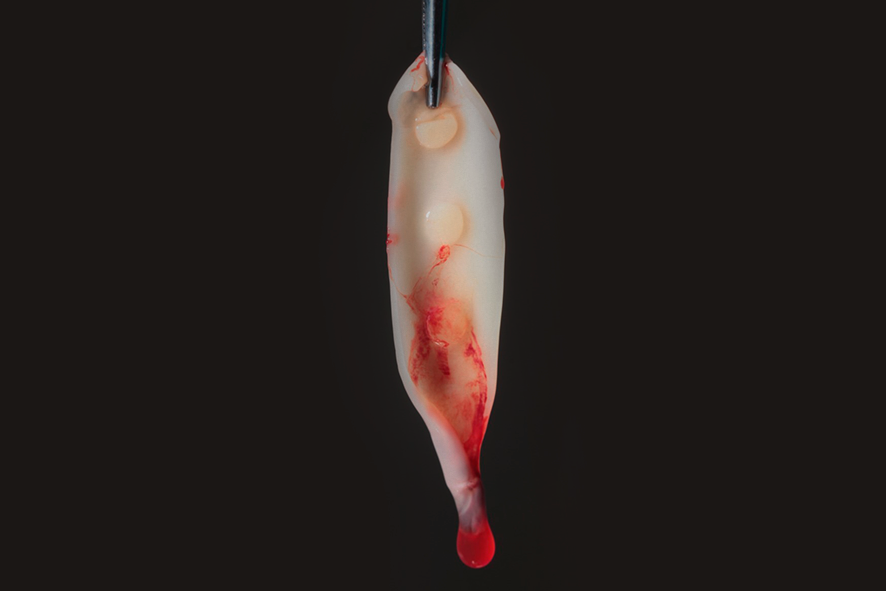 |
Figuras 4 y 5 – En las figuras 4 y 5 observamos las membranas después de la compresión, listas para el uso. En esta fase éstas pueden ser utilizadas picotadas junto al injerto – sticky bone, o como membranas, recubriendo injertos, áreas donadoras y áreas receptoras.
Sobre membranas de colágeno en técnicas de injerto óseo; en el seno maxilar en caso de levantamiento de seno y asociadas a la técnica del sticky bone, que será descripta a seguir. Ya el preparo del plug debe ser realizado insertando el coágulo de fibrina en el pequeño cilindro de la caja de PRF y presionado cuidadosamente con un peso cilíndrico. Tanto la membrana como el plug pueden ser utilizados en un período de 2,5 a 3 horas después de su cosecha. Debiendo ser irrigados con la exudación para evitar su deshidratación.
L-PRF puede ser utilizado en conjunto con biomateriales o para aglutinar partículas óseas formando un bloque llamado de PRF block o sticky bone (figura 6).
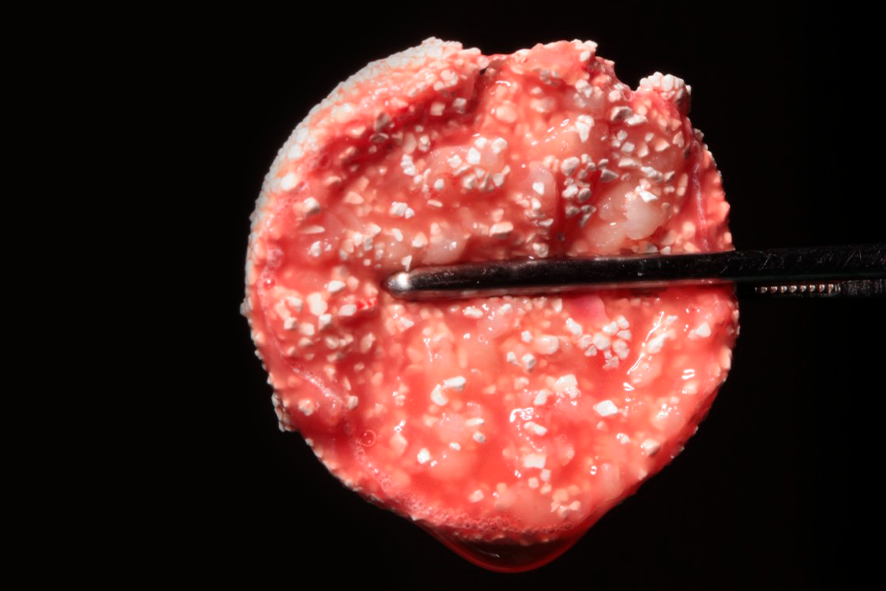
Figura 6 – apariencia del sticky bone o PRF block cuando listo para utilización. Él comprende la mezcla del biomaterial, Nanosynt, de la membrana de L-PRF picotada y del I-PRF que fue añadido. Así, además de mejor aglutinación del injerto, logramos conducirlo mejor al área injertada. Siendo así, mejor indicado para injertos de mayor área de extensión, como por ejemplo: técnica de la tienda para aumento del espesor e injerto de levantamiento de seno maxilar. Después del rellenado con el PRF block, es posible hacer el revestimiento del área injertada con membranas de PRF.
Esta técnica aumenta el volumen para la reconstrucción de grandes defectos, disminuyendo la cantidad de biomaterial necesaria, consecuentemente el costo del procedimiento. Para la preparación del bloque de PRF la sangre del paciente es cosechado en 6 tubos revestidos con vidrio y en 2 tubos revestidos por plástico. Los tubos revestidos por plástico no desencadenan la cascada de la coagulación, permaneciendo el fibrinógeno en estado líquido. Estos tubos deben ser retirados después de 3 minutos de centrifugación, los demás deben ser mantenidos hasta completar el ciclo. El fibrinógeno (líquido amarillo en el interior del tubo revestido por plástico) debe ser retirado en la porción más próxima a las células rojas que quedan depositadas en el fondo del tubo, con una pipeta de plástico, pero sin aspirarlas. El líquido debe ser mantenido en el interior de la jeringa. Al final de la centrifugación de los demás tubos, los coágulos de L-PRF son retirados y suavemente comprimidos, como mencionado previamente, formando las membranas de L-PRF. En un recipiente de vidrio o metal, dos membranas deben ser picotadas con una tijera en pequeños fragmentos y mezclados con 0,5g de un sustituto óseo hasta obtener una mezcla uniforme. 1cc de fibrinógeno líquido (i-PRF) debe ser añadido mezclando suavemente por aproximadamente 5 segundos, modelando el bloque de L-PRF.
L-PRF ha sido indicado en tratamientos de cirugía plástica periodontal, osteonecrosis de los maxilares, comunicación buco-sinusal, regeneración de defectos infra-óseos, preservación alveolar, levantamiento de seno maxilar, lesiones de furca, recesión gingival, cirugías de implantes y se presenta como un excelente coadyuvante en el proceso de regeneración.
SEPA MÁS.
Referencias Bibliográficas
Choukroun, J. (2001) Une opportunit_e en paroimplantologie: le PRF. Implantodontie, 42, 55– 62. French.
Dohan, D. M., Choukroun, J., Diss, A., Dohan, S. L., Dohan, A. J., Mouhyi, J. & Gigly, B. Platelet-rich fibrin (PRF): a second generation platelet concentrate. Part I: Technological concepts and evolution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 101: E37–44.
Pan J, Xu Q, Hou J, Wu Y, Liu Y, Li R, Pan Y, Zhang D. Effect of platelet-rich fibrin on alveolar ridge preservation: A systematic review. J Am Dent Assoc 2019; 150: 766-78. doi: 10.1016/j.adaj.2019.04.025.
Castro AB, Meschi N, Temmerman A, Pinto N, Lambrechts P, Teughels W,
Quirynen M. Regenerative potential of leucocyte- and platelet-rich fibrin. Part A: intra-bony defects, furcation defects and periodontal plastic surgery. A systematic review and meta-analysis. J Clin Periodontol 2017; 44: 67–82. doi: 10.1111/jcpe.12643
Castro AB, Meschi N, Temmerman A, Pinto N, Lambrechts P, Teughels W,
Quirynen M. Regenerative potential of leucocyte- and platelet-rich fibrin. Part B: sinus floor elevation, alveolar ridge preservation, and implant therapy. A systematic review. J Clin Periodontol 2017; 44: 225–234. doi: 10.1111/jcpe.12658
Temmerman A, Vandessel J, Castro A, Jacobs R, Teughels W, Pinto N, Quirynen M. The use of leucocyte and platelet-rich fibrin in socket management and ridge preservation: a split-mouth, randomized, controlled clinical trial. J Clin Periodontol 2016; 43: 990–999. doi: 10.1111/jcpe.12612.
 |
 |

![Capa Blog Nanosynt Carois1 - El L-PRF como coadyuvante a las regeneraciones óseas Capa_Blog-Nanosynt-Carois[1]](https://srv01.fgmdentalgroup.com/wp-content/uploads/2022/12/Capa_Blog-Nanosynt-Carois1-1024x683.png)