As técnicas de enxertia óssea evoluem constantemente na odontologia com o objetivo de alcançar a regeneração óssea e tecidual com menor morbidade e custo e tempo de tratamento reduzidos.
A primeira geração de agregados plaquetários incluía o plasma rico em plaquetas (PRP) e o plasma rico em fatores de crescimento (PRGF). Já o PRF trata-se de um plasma rico em plaquetas que sofre coagulação natural. O uso e obtenção do PRF é mais simples, requer menos tempo, não requer o uso de anticoagulantes, assim como de aditivos artificiais que influenciem na cascata de coagulação como a trombina bovina e o cloreto de cálcio. O uso da fibrina rica em plaquetas e leucócitos (L-PRF) se tornou uma alternativa de tratamento em casos onde há necessidade de regeneração, tanto de tecidos moles quanto de tecidos duros. Esta segunda geração de concentrados plaquetários que são extraídos do sangue e obtidos após processamento por meio de centrifugação foi introduzida por Choukroun e colaboradores em 2001.
O protocolo de obtenção do L-PRF consta da coleta de sangue do próprio paciente por venopunção, em tubos de 9-10mL revestidos por vidro/plástico que devem ser centrifugados imediatamente em alta velocidade a 400g RCF: 2700 rpm durante 12 minutos ou 3000 rpm durante 10 minutos. Após a centrifugação os constituintes do sangue se dividem em três camadas.
No fundo do tubo ficam acumuladas as células vermelhas do sangue, na parte superior o plasma pobre em plaquetas e a camada intermediária é composta pela maior concentração de plaquetas e leucócitos (coágulo de fibrina que chamamos de L-PRF), conforme demonstrado na figura 1.
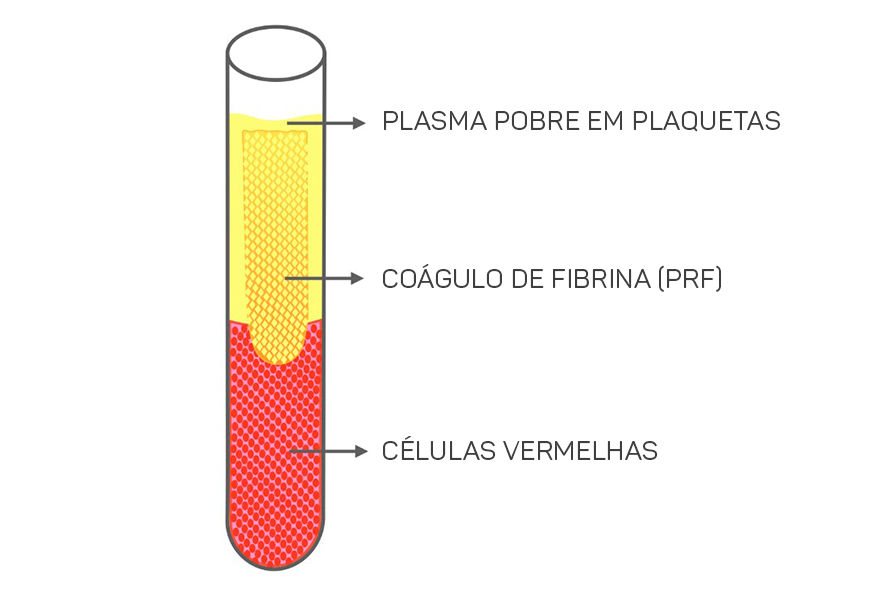
Figura 1 – esquema do tubete de vidro após a centrifugação. É possível observar que, no fundo do tubete estarão as células vermelhas, acima, com mais consistência, o coágulo de fibrina, que será removido com a pinça e utilizado para confecção das membranas e o plasma pobre em plaquetas, que será descartado.
Em poucos minutos a ativação da maioria das plaquetas da amostra de sangue se dá por contato com as paredes de vidro do tubo de coleta o que desencadeia a cascata de coagulação.
O coágulo de L-PRF é rico em fibrina, plaquetas, leucócitos, monócitos e fatores de crescimento. Estudos sugerem um efeito positivo na proliferação, migração, adesão, diferenciação celular e no processo inflamatório, o que justifica o seu amplo uso na odontologia.
Como utilizar clinicamente?
Para o uso clínico do L-PRF o coágulo é removido do tubo com uma pinça e a porção de células vermelhas aderidas ao coágulo é então removida com uma espátula, tesoura ou lâmina de bisturi.
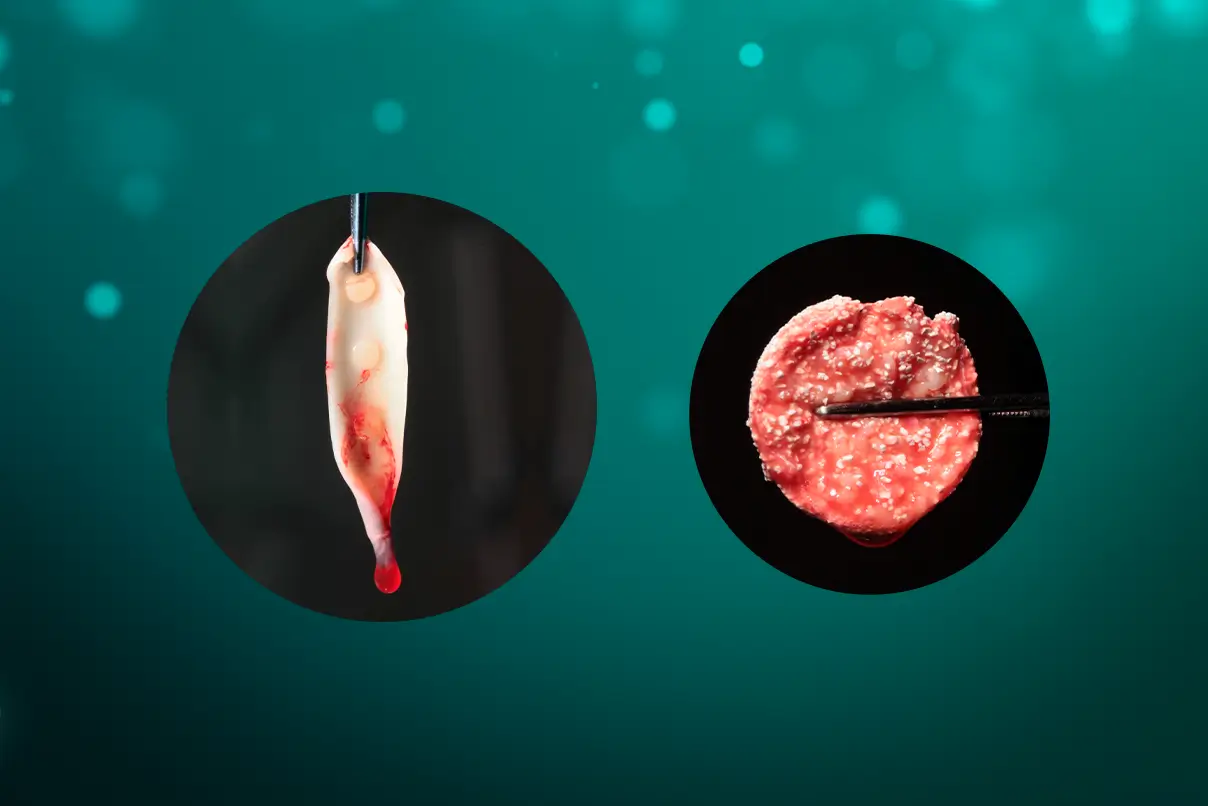
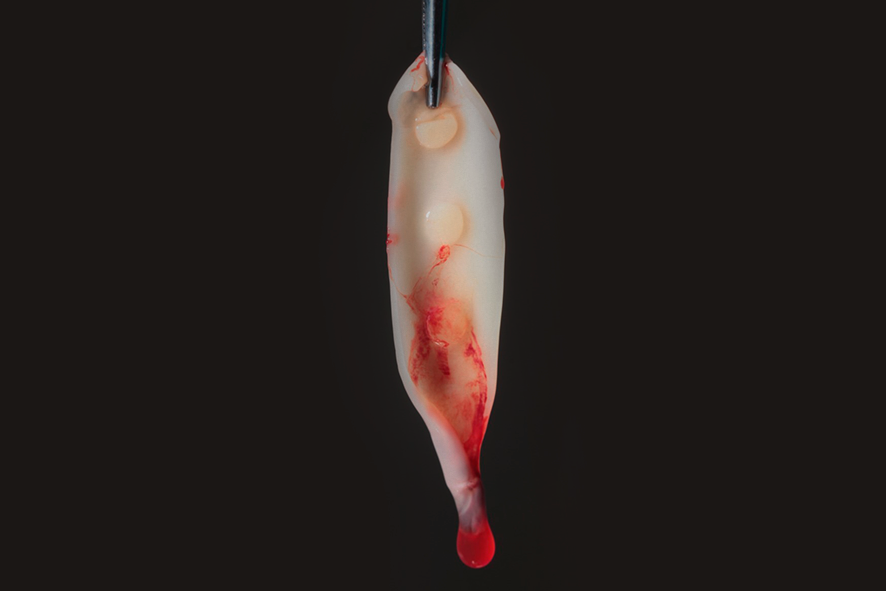
O coágulo de fibrina, por compressão, pode ser transformado em plugs, sendo indicados, por exemplo, para o vedamento de alvéolos pós extração (figura 2), ou membranas com 1mm de espessura, além de servir como arcabouço para a aglutinação de partículas de substitutos ósseos, como o Nanosynt, por exemplo.
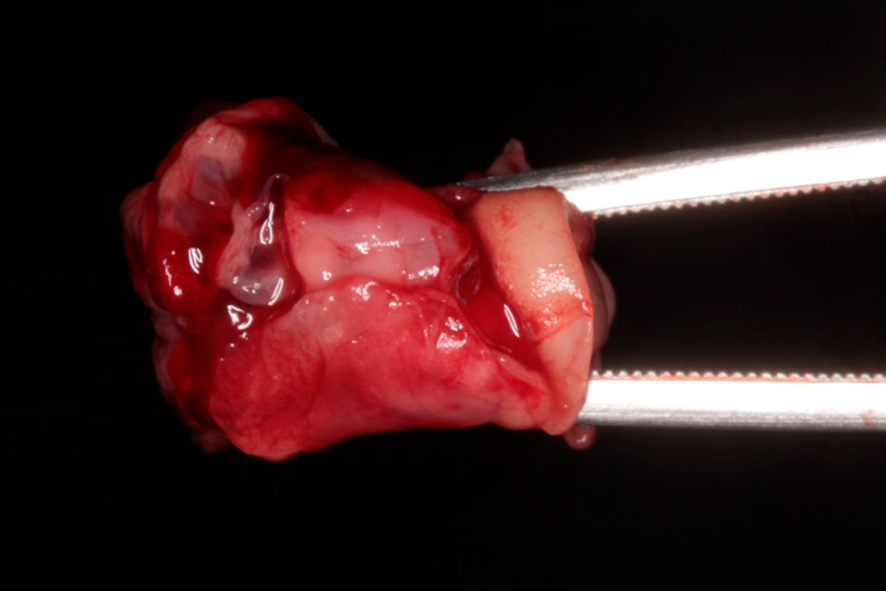
Figura 2 – imagem de um plug de L-PRF, preparado após a compressão em um cilindro. Para a obtenção do mesmo, é necessário a centrifugação do sangue no tubete de vidro, por 12 minutos. Após a centrifugação, deve ser removida a parte intermediária – maior concentração de plaquetas e leucócitos com uma pinça e levada para dentro do cilindro disponível na caixa de L-PRF. Com o auxílio de uma pinça, levar o plug para o local desejado.
Para a formação da membrana, o coágulo de fibrina é posicionado sobre uma superfície perfurada em uma caixa metálica (PRF box) (figura 3), sendo comprimido por ação da gravidade com a ajuda da placa metálica da caixa por um período de 5 minutos.
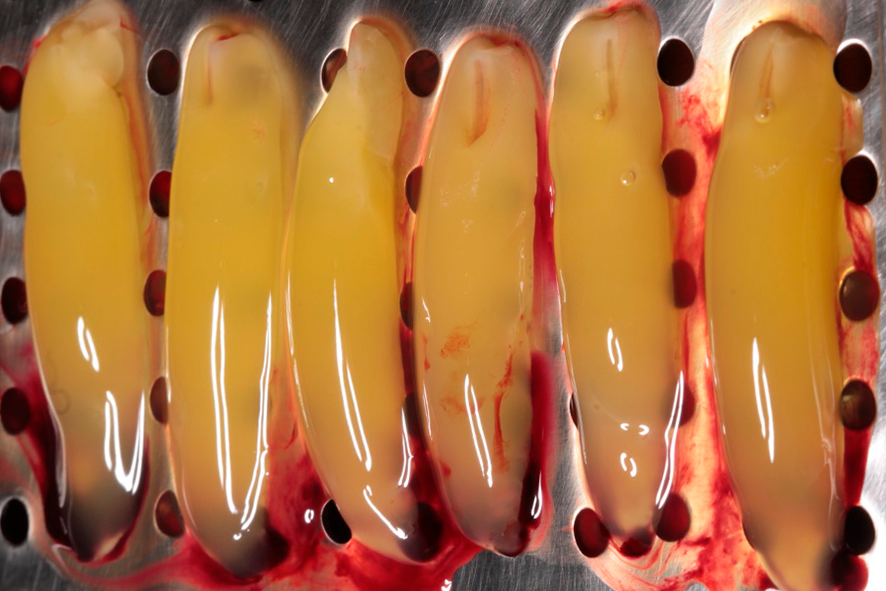
Figura 3 – A figura 3 mostra a aparência do coágulo de fibrina (parte intermediária) assim que removido do tubete de vidro. Estes devem ser comprimidos com a tampa da caixa, para que então as membranas se formem e estejam prontas para o uso. O exsudato que se deriva desse processo pode ser utilizado como fonte de irrigação de biomateriais.
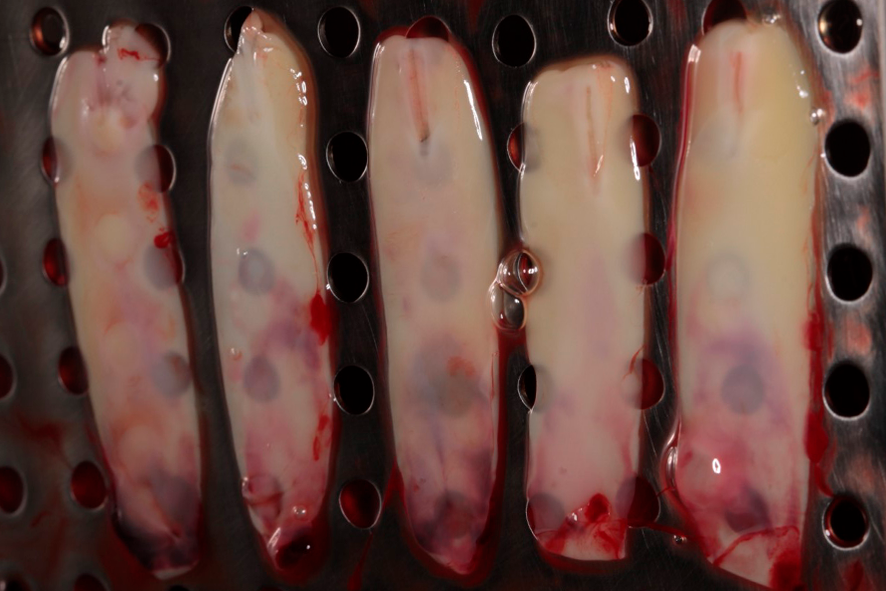
O exsudato liberado pelo coágulo, devido à sua compressão, ficará armazenado no compartimento inferior da caixa. Este exsudato é rico em proteínas (fibronectina e vitronectina) e poderá ser utilizado para hidratar enxertos e biomateriais, assim como para lavar feridas cirúrgicas. As figuras 4 e 5 mostram as membranas após a compressão, já prontas para o uso, podendo ser utilizadas para recobrir o palato que serviu como área doadora de enxerto gengival, assim como na área receptora, para auxiliar na formação de tecido queratinizado;
 |
 |
Figuras 4 e 5 – Nas figuras 4 e 5 observamos as membranas após a compressão, prontas para o uso. Nesta fase as mesmas podem ser utilizadas picotadas junto ao enxerto – sticky bone, ou como membranas, recobrindo enxertos, áreas doadoras e áreas receptoras.
Sobre membranas de colágeno em técnicas de enxertia óssea; no seio maxilar em caso de levantamento de seio e associadas à técnica do sticky bone, que será descrita a seguir. Já o preparo do plug deve ser realizado inserindo o coágulo de fibrina no pequeno cilindro da caixa de PRF e pressionado cuidadosamente com um peso cilíndrico. Tanto a membrana quanto o plug podem ser utilizados em um período de 2,5 a 3 horas após sua coleta. Devendo ser irrigados com o exsudato para evitar sua desidratação.
L-PRF pode ser utilizado em conjunto com biomateriais ou para aglutinar partículas ósseas formando um bloco chamado de PRF block ou sticky bone (figura 6).
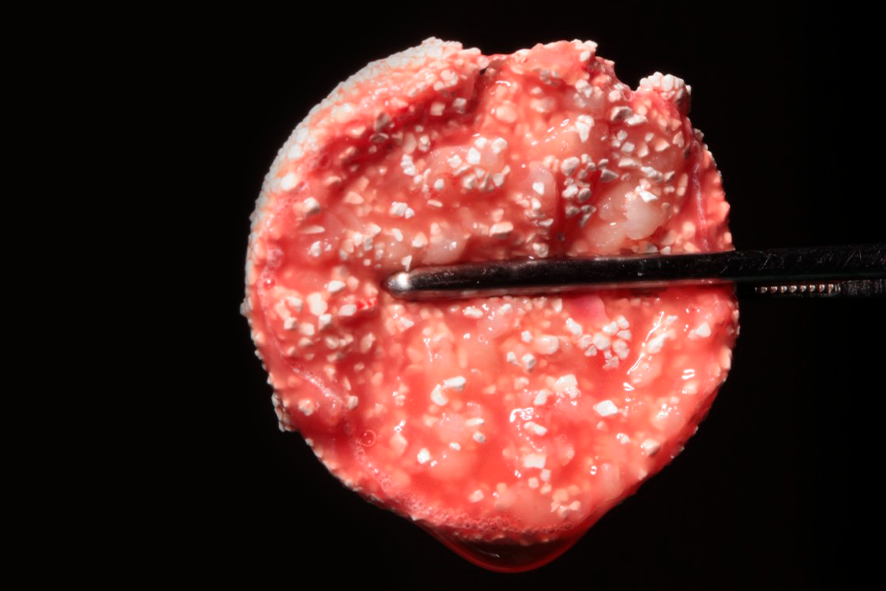
Figura 6 – aparência do sticky bone ou PRF block quando pronto para utilização. Ele compreende a mistura do biomaterial, Nanosynt, da membrana de L-PRF picotada e do I-PRF que foi adicionado. Assim, além de melhor aglutinação do enxerto, conseguimos conduzi-lo melhor à área enxertada. Sendo assim, melhor indicado para enxertos de maior área de extensão, como, por exemplo: técnica da tenda para aumento da espessura e enxerto de levantamento de seio maxilar. Após o preenchimento com o PRF block, é possível fazer o revestimento da área enxertada com membranas de PRF.
Esta técnica aumenta o volume para a reconstrução de grandes defeitos, diminuindo a quantidade de biomaterial necessária, consequentemente o custo do procedimento. Para a preparação do bloco de PRF o sangue do paciente é coletado em 6 tubos revestidos com vidro e em 2 tubos revestidos por plástico. Os tubos revestidos por plástico não desencadeiam a cascata da coagulação, permanecendo o fibrinogênio em estado líquido. Estes tubos devem ser removidos após 3 minutos de centrifugação, os demais devem ser mantidos até completar o ciclo. O fibrinogênio (líquido amarelo no interior do tubo revestido por plástico) deve ser removido na porção mais próxima às células vermelhas que ficam depositadas no fundo do tubo, com uma pipeta de plástico, porém sem aspirá-las. O líquido deve ser mantido no interior da seringa. Ao final da centrifugação dos demais tubos, os coágulos de L-PRF são removidos e suavemente comprimidos, como mencionado previamente, formando as membranas de L-PRF. Em um recipiente de vidro ou metal, duas membranas devem ser picotadas com uma tesoura em pequenos fragmentos e misturadas com 0,5g de um substituto ósseo até obter uma mistura uniforme. 1cc de fibrinogênio líquido (i-PRF) deve ser adicionado misturando suavemente por aproximadamente 5 segundos, modelando o bloco de L-PRF.
L-PRF tem sido indicado em tratamentos de cirurgia plástica periodontal, osteonecrose dos maxilares, comunicação buco-sinusal, regeneração de defeitos infra-ósseos, preservação alveolar, levantamento de seio maxilar, lesões de furca, recessão gengival, cirurgias de implantes e se apresenta como um excelente coadjuvante no processo de regeneração.
Referências Bibliográficas
Choukroun, J. (2001) Une opportunit_e en paroimplantologie: le PRF. Implantodontie, 42, 55– 62. French.
Dohan, D. M., Choukroun, J., Diss, A., Dohan, S. L., Dohan, A. J., Mouhyi, J. & Gigly, B. Platelet-rich fibrin (PRF): a second generation platelet concentrate. Part I: Technological concepts and evolution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 101: E37–44.
Pan J, Xu Q, Hou J, Wu Y, Liu Y, Li R, Pan Y, Zhang D. Effect of platelet-rich fibrin on alveolar ridge preservation: A systematic review. J Am Dent Assoc 2019; 150: 766-78. doi: 10.1016/j.adaj.2019.04.025.
Castro AB, Meschi N, Temmerman A, Pinto N, Lambrechts P, Teughels W,
Quirynen M. Regenerative potential of leucocyte- and platelet-rich fibrin. Part A: intra-bony defects, furcation defects and periodontal plastic surgery. A systematic review and meta-analysis. J Clin Periodontol 2017; 44: 67–82. doi: 10.1111/jcpe.12643
Castro AB, Meschi N, Temmerman A, Pinto N, Lambrechts P, Teughels W,
Quirynen M. Regenerative potential of leucocyte- and platelet-rich fibrin. Part B: sinus floor elevation, alveolar ridge preservation, and implant therapy. A systematic review. J Clin Periodontol 2017; 44: 225–234. doi: 10.1111/jcpe.12658
Temmerman A, Vandessel J, Castro A, Jacobs R, Teughels W, Pinto N, Quirynen M. The use of leucocyte and platelet-rich fibrin in socket management and ridge preservation: a split-mouth, randomized, controlled clinical trial. J Clin Periodontol 2016; 43: 990–999. doi: 10.1111/jcpe.12612.

Shop FGM Implants
Shop FGM Implants
Um mundo de soluções inteligentes, em apenas alguns cliques!
- Condições especiais de parcelamento
- Promoções exclusivas
- Facilidade nos pedidos