Autor: Dr. Bruno Alves Paim
O preenchimento de defeitos ósseos com biomateriais é uma prática cada vez mais comum nos consultórios odontológicos. Utilizando-se de substitutos ósseos, o cirurgião-dentista consegue, hoje, alcançar excelentes resultados dentro do prazo desejado. O processo de enxertia é dependente de alguns fatores que garantam condições para que os osteoblastos possam se proliferar e levar a formação de novo tecido, promovendo a conversão do enxerto em osso, em um processo definido como osteointegração. No processo de enxertia óssea, as principais propriedades de um biomaterial são osteogenicidade, osteoindução e osteocondução. Estes conceitos podem ser definidos de maneira bem simples:
- Osteogenicidade implica na presença de osteoblastos no biomaterial, o qual é capaz de promover a síntese de novo tecido ósseo logo após o procedimento cirúrgico;
- Osteoindução é caracterizado como a capacidade de recrutar novas células formadoras de tecido ósseo para o local de enxertia;
- Osteocondução se refere a capacidade de promover adesão, sobrevivência e proliferação de células ósseas, provendo uma estrutura interconectada para a sedimentação de novo tecido ósseo bem como a formação de novos vasos sanguíneos.
Considerado padrão ouro em procedimentos de enxertia, o osso autógeno é o único a reunir estas propriedades. Entretanto, este procedimento está associado a diversos inconvenientes como maior tempo de recuperação do paciente, pós-operatório doloroso, perda sanguínea, danos em nervos adjacentes ao local de coleta do tecido ósseo, infecção, apenas para citar alguns pontos que são consenso entre os profissionais. Neste cenário o uso de biomateriais de origem sintética surge como alternativa ao osso autógeno. Estes biomateriais sintéticos são em sua maior parte compostos por cerâmicas a base de hidróxiapatita (HA) e β-tricálcio fosfato (β-TCP). Tanto HA quanto β-TCP são altamente biocompatíveis, sendo que a HA possui um maior tempo de degradação, permanecendo no local de implantação por um tempo maior que o β-TCP. Como toda cerâmica sintética, sozinhos estes materiais não possuem propriedades de osteogênese e osteoindução. Assim, a eficácia destes materiais depende em muito de quão eficiente é sua osteocondução.
Analisando mais profundamente a organização do tecido ósseo, notamos que o osso é um tecido nanohíbrido composto por nanocristais de HA e nanofibras de colágeno, que assumem uma estrutura altamente porosa, com diversos poros interconectados. Uma vez que o osso é naturalmente nanoestruturado, materiais sintéticos com estruturas nanométricas se apresentam como a melhor escolha para procedimentos de enxertia. A vantagem deste tipo de material reside na semelhança com o tamanho das partículas de HA, alta porosidade e elevada área de superfície. Os cristais de HA em escala nanométrica aumentam a adesão de osteoblastos, elevando a proliferação e a força de adesão entre estas células e o biomaterial¹. Da mesma forma que a adesão celular, a proliferação e deposição de cálcio são substancialmente maiores em cerâmicas de HA com superfície nanométrica, quando comparadas com as tradicionais cerâmicas micrométricas disponíveis no mercado atualmente¹,². Fato possivelmente relacionado à elevada área de superfície das nanocerâmicas, a qual possibilita uma maior deposição de proteínas relacionadas com o processo de adesão celular.
Além do tamanho dos cristais de HA, o tamanho dos grânulos de HA também interfere com a produção de diversas proteínas relacionadas com o processo de sinalização celular, chamadas de citocinas³,⁴. Estas citocinas são pequenas proteínas produzidas por diversas células com capacidade de modular a formação de tecido ósseo. Citocinas como Interleucina 6 (IL-6) e o fator de necrose tumoral alfa (TNF-α) estão relacionados à ativação de osteoclastos (células ósseas relacionadas com a reabsorção do tecido ósseo). De modo oposto age outra citocina, a IL-187. Esta citocina produzida por células do sistema imune e por osteoblastos é capaz de inibir indiretamente a ativação de osteoclastos ao elevar a produção de GM-CSF⁵,⁶,⁷,. Foi demonstrado em estudo, que grânulos esféricos de HA com tamanho entre 150 e 300µm levam células do sistema imune a produzir menores quantidades de IL-6 e TNF-α, quando comparados ao grupo controle³. Ao diminuir o tamanho do grânulo de HA, os níveis destas citocinas tendem a aumentar, o que poderia levar a uma maior quantidade de osteoclastos e consequente redução na quantidade de osso formado. Da mesma forma como observado para as citocinas IL-6 e TNF-α, partículas esféricas de HA com tamanho entre 150 e 300µm também podem estimular a produção de IL-18, o que leva a uma menor quantidade de osteoclastos⁴. Este balanço entre menores níveis de IL-6 e TNF-α, conjugado a uma elevação nos níveis de IL-18 poderia levar a uma maior quantidade de tecido ósseo formado quando partículas de HA com tamanho igual ou superior a 200 µm são utilizados.
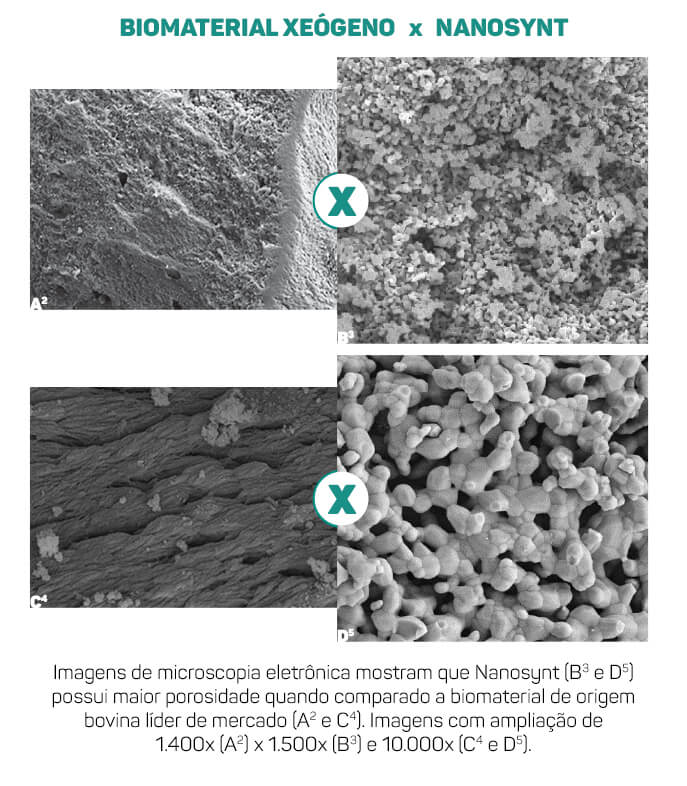
Este conhecimento sobre alta porosidade, nanoestrutura e poros interconectados em biomateriais foram aplicados no novo biomaterial da FGM. Nanosynt possui poros micro e nanoestruturados alinhados com cristais de HA e β-TCP em escala nanométrica. Imagens obtidas da superfície do Nanosynt mostram que os nanocristais de HA e β-TCP possuem tamanho médio de 200nm (Figuras 2 e 3). A união destes nanocristais forma uma intrincada rede de poros nano e micro conectados, que eleva ainda mais a área de superfície e a porosidade do biomaterial da FGM. Com esta organização, Nanosynt apresenta cerca de 80 a 90% de porosidade em sua superfície, o que lhe garante uma excelente molhabilidade.
Estas características de superfície conferem ao Nanosynt uma maior capacidade de formação de tecido ósseo quando comparado a outros biomateriais com superfície micro estruturada. Em trabalho conduzido na Universidade Federal Fluminense (manuscrito no prelo), realizado em pacientes de diversas idades, Nanosynt se mostrou mais eficaz que um enxerto sintético similar largamente conhecido no mercado, apresentando uma formação óssea até 20% maior quando comparado ao outro biomaterial, e cerca de 40% maior quando comparado ao grupo controle (coágulo). Esta maior formação de tecido ósseo também pode ser observada quando Nanosynt é comparado a biomateriais de origem bovina. Trabalho utilizando coelhos mostrou que quando comparado aos mais tradicionais substitutos ósseos do mercado (sintético e bovino), Nanosynt se mostrou mais eficaz que ambos8. Após 4 semanas de aplicação, o grupo de animais que fez uso de Nanosynt apresentou cerca de 23% de novo osso, comparado a 11% do outro biomaterial sintético e 17% do biomaterial de origem bovina. Após 8 semanas, esta diferença se manteve, onde Nanosynt apresentou cerca de 30% de novo osso formado, comparado a 27% do outro biomaterial sintético e a 24% do biomaterial de origem bovina.
A escolha do biomaterial pelo cirurgião-dentista sempre foi pautada por aspectos relacionados a facilidade de uso e preço dos biomateriais. A chegada de produtos mais eficientes e com melhores resultados traz ao profissional um novo horizonte a ser explorado. E a possibilidade de realizar a colocação do implante de maneira mais segura e em menor tempo faz com que o cirurgião-dentista passe a buscar por novas alternativas em detrimento de opções que pouco evoluíram na última década. Este avanço tecnológico é alcançado com a aplicação de novas tecnologias, agregado ao conhecimento sobre os processos bioquímicos de sinalização celular que regulam a formação de novos tecidos.
REFERÊNCIAS
1- Deligianni DD, Katsala ND, Koutsoukos PG, Missirlis YF. Effect of surface roughness of hydroxyapatite on human bone marrow cell adhesion, proliferation, differentiation and detachment strength. Biomaterials. 2001 Jan;22(1):87-2- Kubinová, S.; Syková, E. Nanotechnologies in regenerative medicine. Minim. Invasive Ther. Allied Technol. 2010, 19, 144–156.
3- Laquerriere P, Grandjean-Laquerriere A, Jallot E, Balossier G, Frayssinet P, Guenounou M. Importance of hydroxyapatite particles characteristics on cytokines production by human monocytes in vitro. Biomaterials. 2003 Jul;24(16):2739-47.
4- Grandjean-Laquerriere A, Laquerriere P, Laurent-Maquin D, Guenounou M, Phillips TM. The effect of the physical characteristics of hydroxyapatite particles on human monocytes IL-18 production in vitro. Biomaterials. 2004 Dec; 25(28):5921-7.
5-Yamada N, Niwa S, Tsujimura T, Iwasaki T, Sugihara A, Futani H, Hayashi S, Okamura H, Akedo H, Terada N. Interleukin-18 and interleukin-12 synergistically inhibit osteoclastic bone-resorbing activity. Bone. 2002 Jun;30(6):901-8.
6-Costa-Rodrigues J, Silva A, Santos C, Almeida MM, Costa ME, Fernandes MH. Complex effect of hydroxyapatite nanoparticles on the differentiation and functional activity of human pre-osteoclastic cells. J Biomed Nanotechnol. 2014 Dec;10(12):3590-600.
7- Grandjean-Laquerriere A, Laquerriere P, Laurent-Maquin D, Guenounou M, Phillips TM. Biomaterials. The effect of the physical characteristics of hydroxyapatite particles on human monocytes IL-18 production in vitro. 2004 Dec;25(28):5921-7.